从骨架化的人类遗体(尤其是从老化或混合的骨骼)中提取DNA,一直是人类学身份鉴定具有挑战性的方面。2019年刊登在Journal of Forensic Sciences杂志上的Extractionof DNA from Skeletonized Postcranial Remains: A Discussion of Protocols andTesting Modalities回顾了1990年至2018年间由武装部队医学检查员-武装部队DNA鉴定实验室进行的DNA分析实验。对超过13,000种骨骼样本通过四种不同的提取方法进行DNA提取,然后进☉行以下检测:线粒体DNA测序,STR检测(AmpFlSTRYfilerTM,AmpFlSTR MiniFilerTM,PowerPlex Fusion)及NGS,最后分别对四种提取方法、检测方法↑的成功率进行分析。

研究选取了1999年-2018年间的国防部战∮俘/军事情报局(DPAA)和军队法医∑ 系统的DNA鉴定实验室内收集的样本,样本主要来源于军★事冲突战争遗骸(朝鲜战争、东南亚△战争、一战、二战等)及非〖冲突时间(训练事故等),均为无组织残留的骨骼样本。研究人员共使用了四种不同的DNA提取方案:方法三、使用QIA quick PCR纯化试剂盒通过无机纯化完全脱盐;
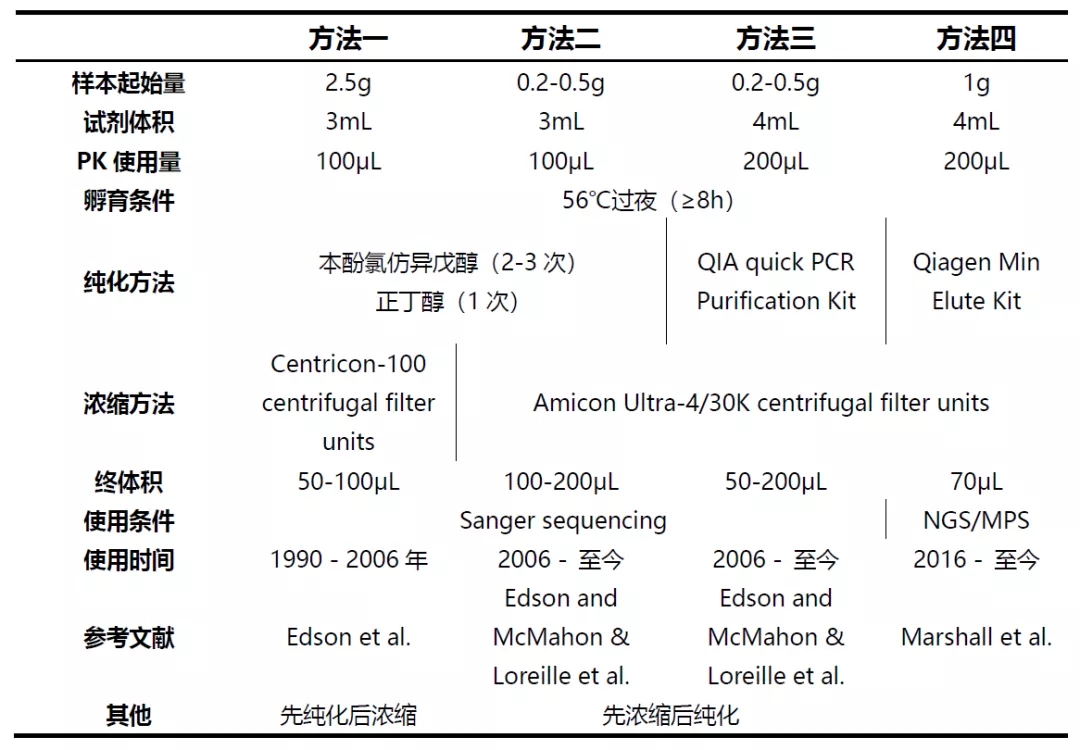
由此可见,提取方法对样本的起始量要求在逐渐降低,从2.5g的起☆始量降低到了0.5g,文中提及目前最低起始量可达到0.05g。但四种方法的孵育温度及条件依旧维持不变,操作细节上的区别主要有以下三点点:1.与之前方法一的顺序不同,方法二和方法三均采用先浓缩后纯化的方案;2. 纯化的方法不同;3. 浓缩采用的耗材不同。
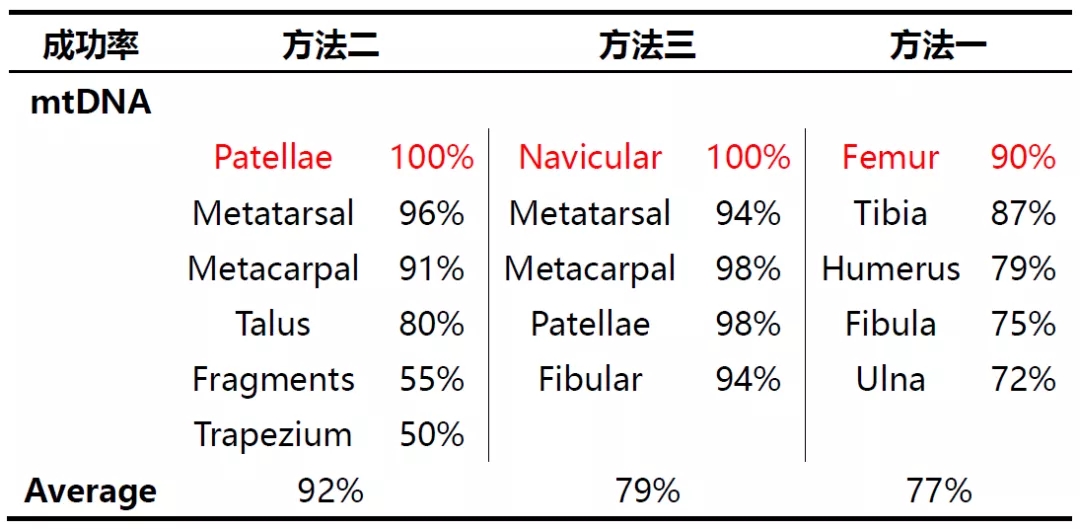
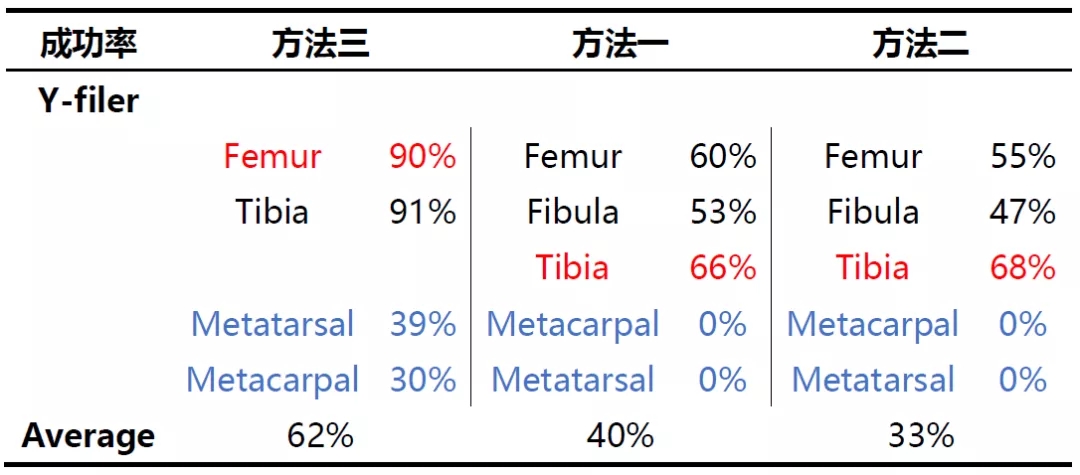
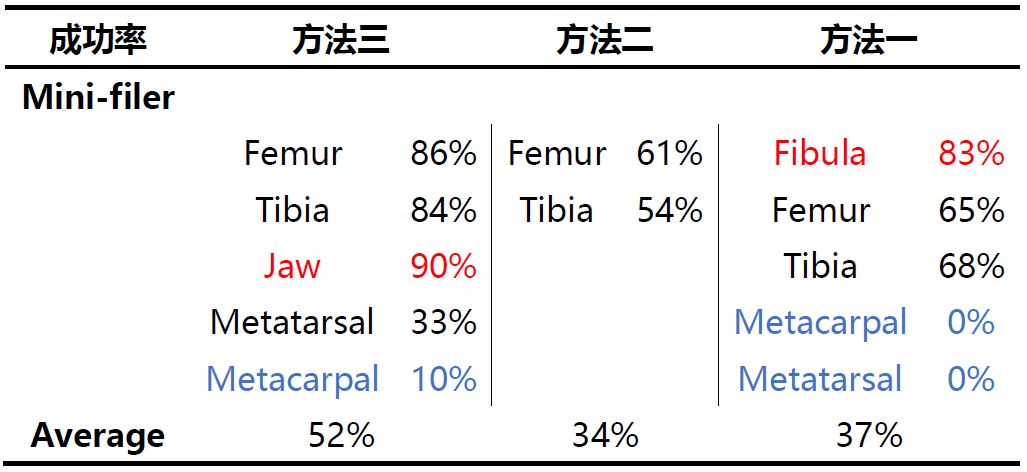
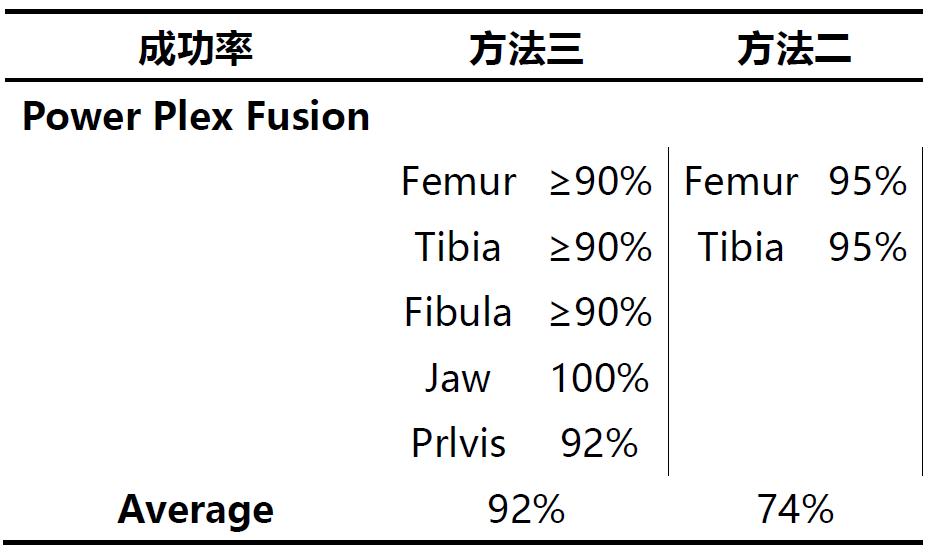
方法二更适用于线粒体DNA的检测实验,其成功率达到91%;方法三更适用于STR检测实验;研究人员分析方法一之所以成功率低◣可能有两方面原因:一是因为其提取试剂中EDTA的含量较低;二是因为其所需的样本起始量较高。而方法三在线粒体DNA方面表现不如方法二的原因可能是由于其浓缩过程使用的column更容易结合大片段DNA,降低了小片段DNA的结合效果。
股骨、腓骨、胫骨来源的样本提取效果通常较好,各种方案均可以获得较高的成功率;而掌骨、脚部骨骼等样本的提取检测效果相对较差,线粒体DNA的提取可以使用方∮法二和方法三,但STR的检测中各类提取方案的检测效果均很差。
图1 人体骨骼〓结构图
Power plex fusion试剂盒的检测成功率显著高于Mini filer和Y-filer,Mini-filer和Y-filer的设计初衷就是为了检测降解样本,但本研究发现在使用方法二进行提取的样本检测时,这两个试剂盒的检测成功率(52%和56%)显著低于fusion(92%)。研究人员分析一结果的原因可能是由于实验室内的操作误差导致。同时研究人员也发现Fusion、mini-filer的检测结果具有一致性,很少出现mini-filer检测不出来而fusion可以检测出的结果↘。因此无论测试的骨骼来源如何,方法二是线▲粒体DNA测序的最佳提取方案;对于STR测试,方法三则可以提供更佳的结果。但方法的选择取决于样本的状态、环境以及检测的目的,必≡须根据实际情况进行综合考虑。因此方法的选择并非单一的“Yes”或者“No”,而是综合因素考虑下的选择。文中介绍的这四类方法也是最为基础的方案,随着科技的发展和样本复杂度的提升,骨骼DNA的提取方法也在不断地优化,以期望能进一步提高样本的检测成功率。https://doi: 10.1111/1556-4029.14050









 中文
中文 English
English



